Ocena żywotności komórek oraz oznaczanie śmierci komórkowej przy użyciu mikrobioreaktora BioLector. Podejścia aplikacyjne do pomiarów jodku propidyny
W niniejszej nocie aplikacyjnej prezentowane są pomiary online jodku propidyny (PI) podczas prowadzenia procesów hodowli przy użyciu mikrobioreaktora BioLector. Metoda ta umożliwia uzyskanie szybkiej (w czasie rzeczywistym) informacji na temat żywotności komórek i ma zastosowanie na przykład w wysokoprzepustowych badaniach cytotoksyczności w formacie 48-dołkowym.
Ogólnie rzecz biorąc, metodę barwienia komórek za pomocą jodku propidyny (PI) wykorzystuje się do oceny żywotności komórek kultur bakteryjnych z produktów spożywczych, próbek klinicznych, procesów środowiskowych lub fermentacyjnych, lub w celu scharakteryzowania komórek eukariotycznych.
W badaniach mikrobiologicznych testy żywotności bakterii są kluczowym narzędziem analizy, szeroko stosowanym do oceny właściwości przeciwdrobnoustrojowych, takich jak wysokoprzepustowe badania cytotoksyczności lub w testach toksyczności często przeprowadzanych za pomocą premiksowanych, gotowych do użycia zestawów barwiących opartych na wykrywaniu integralności błony.
Jodek propidyny (PI) jest uniwersalnym barwnikiem, najczęściej stosowanym do identyfikacji martwych komórek w populacji i jako przeciwbarwa w wielokolorowych technikach fluorescencyjnych. Może przenikać tylko martwe komórki z zakłóconymi błonami komórkowymi, nie wnika natomiast do żywych komórek z nienaruszonymi błonami komórkowymi.
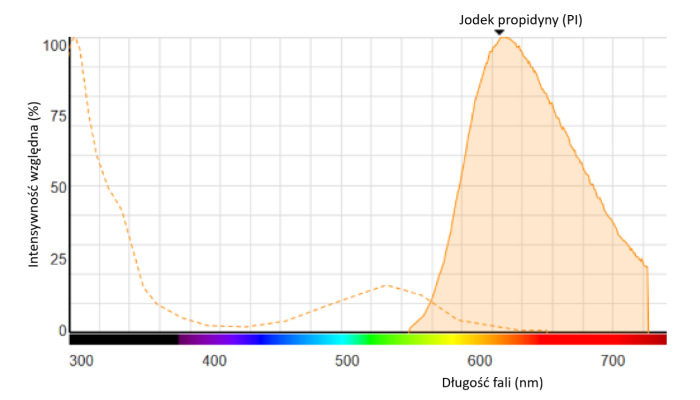
Jodek propidyny interkaluje z komórkowym kwasem dezoksyrybonukleinowym (DNA), emitując czerwone światło fluorescencyjne.
PI wiąże się z DNA poprzez interkalację między parami zasad; z niewielką lub żadną preferencją sekwencji z jedną cząsteczką barwnika na cztery do pięciu par zasad, podobnie jak bromek etydyny. W roztworze wodnym maksima wzbudzenia/emisji barwnika wynoszą 493/636 nm.
Po związaniu barwnika maksimum wzbudzenia fluorescencji przesuwa się o około 30-40 nm do zakresu długości fali czerwonej. Maksimum emisji fluorescencji jest przesunięte o 15 nm do zakresu długości fali niebieskiej, co daje maksimum wzbudzenia przy 535 nm i maksimum emisji fluorescencji przy 617 nm.
Wraz ze wzrostem odsetka martwych do żywych komórek czerwona fluorescencja PI wzrasta liniowo.
PI zapewnia szybką, ilościową analizę i możliwość szerokiego zastosowania w różnych urządzeniach: mikroskopach fluorescencyjnych, konfokalnych laserowych mikroskopach skaningowych, cytometrach przepływowych czy czytnikach mikropłytek.
Ryc. 1: Widmo fluorescencji PI związanego z DNA
Metody
Hodowla E. coli: Hodowla E. coli Bl21 (DE3) odbywa się w BioLectorze w temperaturze 37°C i prędkości wytrząsania 800 rund na minutę (rpm) oraz objętości napełniania 800 μl na studzienkę w każdej studzience uprawowej płytki do mikromiareczkowania FlowerPlate, typu BOH2 mikropłytka do mianowania (MTP). Dla pożywek uprawowych stosuje się Wilms-MOPS o stężeniu buforowym 50 mM lub 200 mM.
Stężenie PI: Roztwór podstawowy PI (Sigma Aldrich, 2019) przygotowuje się poprzez rozpuszczenie 1 mM w buforowanej fosforanowo soli fizjologicznej (PBS). Roztwór podstawowy musi być sterylnie filtrowany i przechowywany w temperaturze 4°C. Ze względu na to, że PI interkaluje DNA, końcowe stężenie PI w pożywce hodowlanej nie powinno być niepotrzebnie wysokie, aby zminimalizować zagrożenie dla użytkownika.
W nocie aplikacyjnej końcowe stężenie PI w podłożu hodowlanym wynosiło 5 μM.
W przypadku mniejszej ilości sygnałów fluorescencji krzyżowej zaleca się stosowanie bezbarwnych pożywek uprawowych.
Inicjowanie śmierci komórki: Aby wywołać śmierć komórki podczas tej przykładowej hodowli, temperaturę ustawia się na 50°C albo dodaje się czysty metanol (MeOH) 7 godzin po rozpoczęciu hodowli.
Oznaczanie śmierci komórki: Po indukcji śmierci komórki PI przenika do uszkodzonych błon komórkowych i wiąże się z DNA, powodując przesunięcie fluorescencyjne. Sygnał jest następnie wykrywany przez moduł filtra PI.
Moduł filtra PI: Aby oznaczanie martwych komórek w BioLectorze zakończyło się sukcesem, niezbędny jest moduł filtra PI (ID filtra: 432) o piku wzbudzenia 532 nm i piku emisji 620 nm.
Wyniki
Poniżej przedstawiono różne przykłady zastosowania wykrywania zjawiska śmierci komórek w BioLector Pro za pomocą barwienia PI.
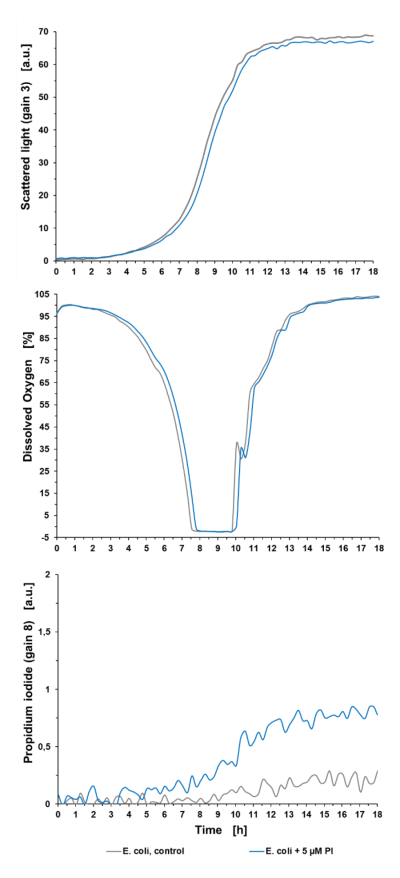
Sygnały fluorescencji tła: Eksperyment z hodowlą wstępną (patrz ryc. 2) pokazuje, że wzrost mikroorganizmów był minimalnie osłabiony o 5 µM PI w porównaniu z kulturą niebarwioną (E. coli, control), co zaskutkowało dłuższą fazą opóźnienia wynoszącą +0,5 h, widoczną w świetle rozproszonym oraz w sygnale tlenu rozpuszczonego (DO). Ponadto można zaobserwować sygnał krzyżowy fluorescencji tła PI w niebarwionej kulturze i rosnący sygnał PI tła w kulturze traktowanej PI. Może to być spowodowane z jednej strony fluorescencją innych metabolitów podczas wzrostu. Z drugiej strony, rozpuszczony PI jest w stanie przeniknąć również przez błonę komórkową żywych komórek. Rozerwanie błony powstaje na przykład w wyniku podziału komórki, poprzez syntezę ściany komórkowej lub uszkodzenie podczas stresu. Widoczny jest zatem wzrost sygnału PI w populacjach żywych komórek w czasie. Ten sygnał tła powinien być zawsze brany pod uwagę w celu uniknięcia nieprawidłowego wykrywania żywych komórek i oznaczania ich jako komórek martwych. Dla lepszego porównania wpływu różnych czynników stresowych (MeOH lub szok termiczny), czynniki stresowe stosowano w tym samym czasie hodowli (7 godzin) we wszystkich eksperymentach.
Ryc. 2: Eksperyment przeduprawowy pokazujący wpływ 5 μM PI na wzrost bakterii, DO i sygnał PI hodowli bakteryjnej w mikrobioreaktorze BioLector. Hodowla okresowa E. coli BL21 typu dzikiego w Wilms-MOPS (zawierająca 10 g/l glicerolu). Hodowle prowadzono na płytce do mikromiareczkowania FlowerPlate® (MTP-48-BOH2) o V0 = 800 μL i n = 800 obr./min w temperaturze 37 °C. Wyniki przedstawiają średnie wartości trzech powtórzeń eksperymentu z następującymi współczynnikami zmienności (CV):
Dla sygnału światła rozproszonego: 0,58% dla E. coli control i 0,44% dla E. coli +5 µM PI.
Dla sygnału DO: 0,50% dla E. coli control i 0,56% dla E. coli +5 µM PI.
Dla sygnału PI: 5,99 % dla E. coli control i 3,85 % dla E. coli +5 µM PI.
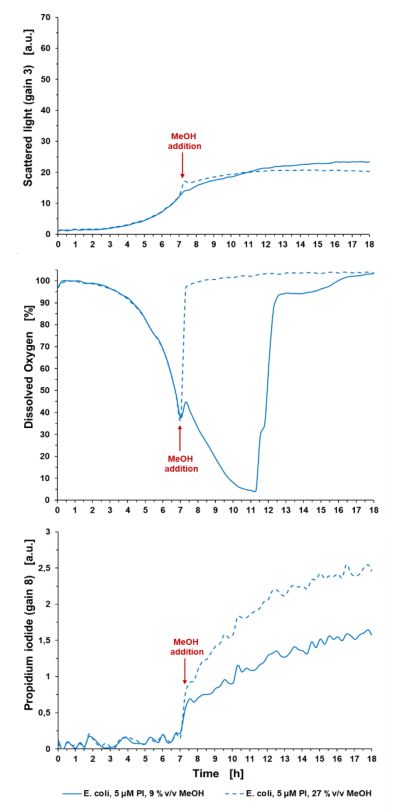
Badania cytotoksyczności: Dodatkowym zastosowaniem barwienia i wykrywania PI w BioLectorze jest badanie cytotoksyczności. W następnym przykładzie kultura E. coli BL21 (DE3) jest poddawana czynnikowi stresu przez dodanie MeOH, jak pokazano na ryc. 3.
Ryc. 3: Badania cytotoksyczności z wykorzystaniem różnych stężeń MeOH jako czynnika stresowego dla hodowli E. coli. Hodowla okresowa E. coli BL21 typu dzikiego w Wilms-MOPS (z 10 g/l glicerolu), z dodatkiem MeOH z 9 %v/v lub 27 %v/v w końcowym stężeniu. Hodowle prowadzono w FlowerPlate® MTP (MTP-48-BOH2) z V0 = 800 µl i n = 800 obr. na min. w temperaturze 37°C. Wyniki przedstawiają średnie wartości trzech powtórzeń eksperymentu z następującymi współczynnikami zmienności (CV):
Dla światła rozproszonego: 5,33% dla E. coli control i 7,09% dla E. coli +5 µM PI.
Dla sygnału DO: 0,51% dla E. coli control i 1,24% dla E. coli +5 µM PI.
Dla sygnału PI: 4,27% dla E. coli control i 4,07% dla E. coli +5 µM PI.
Po 7 godzinach czasu hodowli dodanie 27 %v/v MeOH zatrzymało wzrost, wykrywalny w sygnale światła rozproszonego i w DO: Sygnał DO wzrósł do wartości początkowej (100%) natychmiast po dodaniu MeOH, co wskazuje na rozpoczęcie procesu śmierci komórki. Dodanie 9 %v/v MeOH doprowadziło do spowolnienia sygnału światła rozproszonego i zmniejszenia nachylenia wzrostu skorelowanego z sygnałem DO. Na przykład na wykresie 2 komórki kontrolne osiągają limit O2 ze względu na szybkie tempo wzrostu w porównaniu z komórkami poddanymi stresowi z 9%v/v na wykresie 3. Końcowy sygnał PI po 18 godzinach wynosi 2,54 a.u. dla komórek poddanych działaniu 27 %v/v MeOH i 1,57 a.u. dla komórek poddanych działaniu 9%v/v MeOH. Wartości są wygaszane w stosunku do medium zawierającego 5 μM PI.
Ważne jest, aby wziąć pod uwagę, że sygnał ten jest wartością względną i jest wysoce zależny od punktu czasowego pomiaru i końcowej liczby komórek ze względu na czas ekspozycji komórek na PI, a zatem wspomniane powyżej sygnały tła rosną z czasem. Zatem traktowanie MeOH i oznaczanie PI należy zawsze przeprowadzać w tym samym punkcie czasowym.
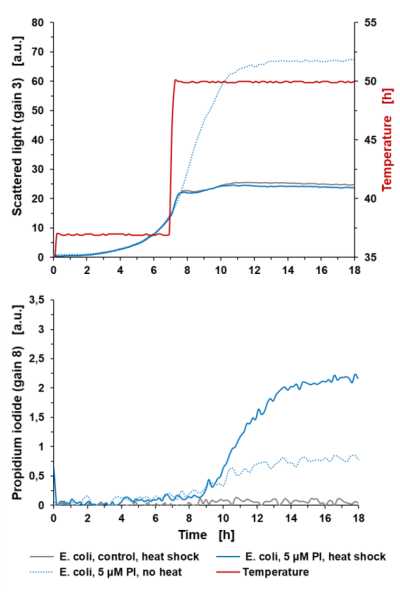
Oznaczanie lizy komórek: Pomiar PI w BioLectorze może pomocnym narzędziem do oznaczania lizy komórek w trakcie eksperymentu hodowlanego. W poniższym przykładzie liza komórek jest indukowana poprzez zwiększanie temperatury hodowli z 37 °C do 50 °C (po upływie 7 godzin), jak pokazano na ryc. 4. Sygnał światła rozproszonego nie wykazuje dalszego wzrostu dla E. coli z 5 μM PI, a także dla szczepu kontrolnego godzinę po rozpoczęciu obróbki cieplnej. Krzywa wzrostu E. coli (+5 μM PI) bez obróbki cieplnej wykazuje wykładniczy wzrost, aż do rozpoczęcia fazy stacjonarnej po 11 godzinach. Z opóźnieniem wynoszącym 2 godziny po obróbce cieplnej komórki zaczynają lizować, a tym samym sygnał PI wzrasta liniowo i nasyca się około 14 godzin czasu hodowli. Opóźnienie wynoszące 2 godziny jest spowodowane czasem potrzebnym na rozprowadzenie ciepła w płynie i działanie w komórkach. Jeśli chodzi o krzywą PI szczepu niepoddanego obróbce cieplnej, podczas wykładniczej fazy wzrostu widoczny jest sygnał fluorescencji tła.
Ryc. 4: Oznaczanie lizy komórek w aparacie BioLector za pomocą barwienia PI. Hodowla okresowa E. coli BL21 typu dzikiego w Wilms-MOPS (zawierająca 10 g/l glicerolu). Hodowle prowadzono w FlowerPlate® MTP (MTP-48-BOH2) z V0= 800 µl i n=800 rpm w 37°C. Wyniki przedstawiają średnie wartości trzech powtórzeń eksperymentu z następującymi współczynnikami zmienności (CV):
Dla sygnału światła rozproszonego: 1,86% dla E. coli control, 1,49% dla E. coli +5 µM PI i 0,44% dla E. coli +5 µM PI (bez obróbki cieplnej).
Dla sygnału PI: 6,75% dla E. coli control i 3,96% dla E. coli +5 µM PI i 3,85% dla E. coli +5 µM PI (bez obróbki cieplnej).
Oznaczanie komórek poddanych stresowi: Połączenie rozproszonego światła i sygnału PI jest przydatne do identyfikacji komórek poddanych stresowi w eksperymencie hodowlanym. W poniższym przykładzie E. coli BL21 hodowano w pożywce Wilms-MOPS stosując dwa różne stężenia buforu MOPS. Na ryc. 5 przedstawiono wyniki eksperymentu dotyczące światła rozproszonego, DO, pH i PI w stosunku do czasu hodowli.
Ryc. 5: Oznaczanie komórek poddanych stresowi za pomocą pomiaru PI w BioLector Pro. Hodowla okresowa E. coli BL21 typu dzikiego w Wilms-MOPS (z 10 g/L glicerolu) zbuforowana 50 mM MOPS lub 200 mM MOPS odbyła się w FlowerPlate® MTP (MTP-48-BOH2) z V0= 800 µl i n = 800 rpm w 37°C. Wyniki przedstawiają średnie wartości trzech powtórzeń eksperymentu z następującymi współczynnikami zmienności (CV):
Dla światła rozproszonego: 0,57 % dla E. coli 5 µM+PI (bufor 50 mM), 0,45 % dla E. coli 5 µM+PI (bufor 200 mM),
Dla pH: 0,17 % dla E. coli 5 µM+PI (bufor 50 mM) i 0,26 % dla E. coli 5 µM+ PI (bufor 200 mM),
Dla DO: 1,08% dla E. coli 5 µM+PI (bufor 50 mM) i 2,14% dla E. coli 5 µM+PI (bufor 200 mM),
Dla sygnału PI: 2,93% dla E. coli 5 µM+PI (bufor 50 mM) i 3,66% dla E. coli 5 µM+PI (bufor 200 mM).
Ciągła niebieska linia reprezentuje wyniki hodowli w buforowanym Wilms-MOPS 200 mM, zaś linia przerywana wyniki pożywki buforowej 50 mM. Gdyby skupić się wyłącznie na sygnale biomasy, można założyć, że biomasa wzrasta do wyższych wartości w środowisku buforowym 50 mM niż w nośniku buforowanym 200 mM. Jednak sygnały PI i DO pokazują przeciwne wyniki. Tak więc nie jest to spowodowane biomasą, ale cząstkami uwalnianymi do mediów z powodu rozerwania komórek. Wartość pH niższej kultury buforowej spada gwałtownie poniżej pH 5,5, a tym samym poniżej optymalnego zakresu pH podczas fazy wzrostu wykładniczego od 5 do 9 godzin. Prowadzi to do zatrzymania wzrostu potwierdzonego sygnałem DO, który wystrzeliwuje w górę po 9 godzinach, gdy tylko pH spadnie poniżej pH 5,5. W konsekwencji DO skacze do wartości początkowej 100 %. Natomiast pH w podłożu buforowym 200 mM jest bardziej stabilne. Podczas fazy wykładniczego wzrostu spada z pH 7,3 do 6,5 po 9,5 godz. Jeśli chodzi o sygnał DO, przypuszczalnie przesunięcie diauxiczne jest widoczne po 10 godzinach kultywacji. Tutaj E. coli zużywa wyprodukowany octan, co powoduje wolniejszy wzrost DO pod koniec uprawy. Ponadto pH wzrasta do 6,7. Ogólnie rzecz biorąc, optymalne pH może być zapewnione podczas całego procesu hodowli partii, co prowadzi do lepszej kondycji bakterii w podłożu buforowanym 200 mM w porównaniu z niższymi buforowanymi. Sygnał PI wykazuje znacznie wyższy sygnał niższej kultury buforowej w porównaniu do stężenia buforu 200 mM. W porównaniu z hodowlą o wysokim poziomie buforowania, sygnał PI niższej kultury wzrasta wykładniczo po 11 godzinach czasu hodowli z powodu rozerwania komórek spowodowanego niskim pH jako czynnikiem stresowym. Pod koniec procesu uprawy wartość ta jest 2,5 razy wyższa niż sygnał tła kultury buforowanej 200 mM. Z informacji o sygnale światła rozproszonego w połączeniu z sygnałem PI można stwierdzić, że wzrost mediów buforowanych 50 mM nie jest lepszy. Niemniej jednak jest to proces lizy komórek, który możemy prześledzić pod koniec hodowli. Liza ta prowadzi do zwiększenia fragmentów w bulionie hodowlanym, a tym samym do zwiększenia sygnału rozproszonego światła, a także do wzrostu sygnału PI, ze względu na dostępne wolne DNA.
Konkluzja
Niniejsza nota aplikacyjna zawiera obszerne przykłady zastosowań wykorzystujących metodę barwienia PI w BioLectorze do identyfikacji martwych lub poddanych czynnikom stresu komórek podczas prowadzenia procesów hodowli. Nadal istnieje wiele możliwości rozwoju tej metody, takich jak kalibracja surowego sygnału PI z liczbą martwych komórek. Ponadto w przyszłości mogą być opracowywane testy żywotności żywych/martwych komórek przy użyciu dodatkowych modułów filtrujących do pomiaru frakcji żywych komórek, co umożliwi pomiar metryczny martwych/żywych komórek w stosunku do całkowitej liczby komórek.
Application Note: Determination of cell death in the BioLector® II/ Pro.


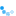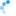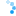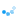 Please wait...
Please wait...