WKRACZAMY W NOWĄ ERĘ ZGODNOŚCI: Jakie zmiany wprowadza nowy Aneks 1 do GMP dla środowisk pomieszczeń czystych i systemów wodnych?
GMP (ang. Good Manufacturing Practice) – Dobre Praktyki Wytwarzania – to zbiór wymaganych zasad i wytycznych określających minimalne wymagania, jakie producent musi spełnić, aby zapewnić niezmiennie wysoką jakość swoich produktów w każdej partii zgodnie z ich przeznaczeniem. Podstawową zasadą GMP jest wyeliminowanie z procesu wytwarzania, jako niedopuszczalnych, działań przypadkowych. Działania na rzecz jakości muszą być: zaplanowane, skoordynowane i kontrolowane. Przestrzeganie zasad Dobrej Praktyki Wytwarzania przyczynia się do: zapewnienia jakości produktu, zapobiegania pomyłkom, wykluczenia zanieczyszczeń krzyżowych.
Nowy Załącznik 1 do dyrektywy GMP, który obowiązuje od 25 sierpnia 2023 r., dotyczy wytwarzania sterylnych produktów leczniczych dla ludzi oraz weterynaryjnych produktów leczniczych.
Oryginalna wersja Załącznika 1 została częściowo zmieniona w latach 1993, 2003 i 2007. Jednak nigdy nie dokonano pełnej aktualizacji, chociaż od tego czasu nastąpiły znaczące zmiany w technologii, przepisach i GMP poprzez przyjęcie Wytycznych ICH* Q9 (Jakość, Zarządzanie Ryzykiem) i Q10 (System Jakości Farmaceutycznej). Sporządzony przez firmę Eudralex poprawiony Aneks 1 tom 4 do Dyrektywy wyjaśnia, w jakim stopniu Q9 i Q10 powinny być przestrzegane przy projektowaniu i wdrażaniu obiektów, sprzętu i procesów do wytwarzania sterylnych produktów leczniczych.
Zgodność ze zmienionym załącznikiem 1 do Rozporządzenia EU GMP
Zmieniony załącznik 1 do dyrektywy GMP dostarcza kompleksowych wskazówek producentom produktów sterylnych. Zmiany obejmują projektowanie i kontrolę obiektów, sprzętu, systemów i procedur zapewniających zapobieganie zanieczyszczeniu mikrobiologicznemu, cząstkami stałymi i endotoksynami/pirogenami.
Należy zauważyć, że te nowe przepisy są korzystne nie tylko w przypadku wytwarzania produktów sterylnych, ale w przypadku wszelkich produktów, w przypadku których ważna jest kontrola i redukcja skażenia mikrobiologicznego, cząstek stałych oraz endotoksyn/pirogenów.
Aneks 1 w skrócie:

Kluczowa jest Strategia Kontroli Zanieczyszczeń
Zmieniony Załącznik 1 podkreśla znaczenie stosowania zasad Zarządzania Ryzykiem w Jakości (QRM), zapewnienia ciągłego monitorowania środowiska i konieczności opracowania Strategii Kontroli Zanieczyszczeń (CCS).
Zgodnie z Załącznikiem 1, CCS (Contamination Control Strategy) to:
"planowany zestaw kontroli mikrobiologicznej, endotoksyn/pirogenów i cząstek stałych, wywodzący się z aktualnej wiedzy o produkcie i procesie, który zapewnia wydajność procesu i jakość produktu. Kontrole mogą obejmować parametry i atrybuty związane z substancjami czynnymi, materiałami i składnikami substancji pomocniczych i produktów leczniczych, warunkami pracy obiektu i sprzętu, kontrolami w trakcie procesu, specyfikacjami gotowego produktu oraz powiązanymi metodami i częstotliwością monitorowania i kontroli."
Jak należy rozumieć tę definicję?
Dokument CCS jest dokumentem zbiorczym; stanowi podsumowanie wszystkich działań mających na celu identyfikację, kontrolę i zapobieganie zanieczyszczeniom w każdym krytycznym punkcie kontroli, tak, aby dokument mógł poprowadzić odbiorców (inspektorów, auditorów, pracowników zakładu) po procesie produkcji.
Szczególnie ważne są następujące elementy:
- Zidentyfikowanie źródła zanieczyszczeń,
- Zdefiniowanie krytycznych punktów kontroli,
- Zdefiniowanie ryzyk procesowych oraz zapobieganie ryzykom,
- Zbudowanie własnej strategii monitorowania i kontroli.
CCS – jako system uwzględniający wszystkie integralne elementy wytwarzania produktów farmaceutycznych – powinien obejmować następujące zagadnienia:
- Skażenie mikrobiologiczne,
- Czyszczenie i dezynfekcja,
- Zapewnienie sterylności,
- Projekt obiektu,
- Zanieczyszczenie chemiczne i zanieczyszczenie cząstkami,
- Inne formy skażenia, które mogą wynikać z pomyłek, uszkodzeń opakowań pierwotnych lub wtórnych, problemów z dystrybucją i wahań środowiskowych.
To, czy ostateczna Strategia Kontroli Zanieczyszczeń (CCS) ma mieć formę jednego dokumentu, czy też serii dokumentów, będzie zależeć od wielkości danego zakładu i zakresu prowadzonej działalności. Wymagane przepisami informacje można ująć bezpośrednio w Strategii lub powiązać z innymi dokumentami. Najważniejsze jest to, aby opisane elementy były oparte na ryzyku i naukowo uzasadnione.
Monitoring systemów wodnych i środowiska – co musisz wiedzieć
Załącznik 1 do Rozporządzenia GMP podkreśla, że kwalifikacja/klasyfikacja systemów wodnych oraz monitorowanie pomieszczeń czystych i środowiska są niezwykle istotne.
Systemy przepływu powietrza czy wody w środowiskach farmaceutycznych są definiowane w Aneksie 1 jako media krytyczne.
W celu zapewnienia zgodności mediów krytycznych z wymogami GMP oraz zapobiegania zdarzeniom niepożądanym konieczne jest podejmowanie działań takich jak: walidacja, kontrola zmian (Change Control), zarządzanie ryzykiem, tworzenie dokumentacji i rysunków technicznych, korygowanie na bieżąco, systematyczne pobieranie próbek oraz ich testowanie.
Wszystkie te działania ułatwiają rozwiązania firmy Beckman Coulter Life Sciences do analizy całkowitego węgla organicznego, monitorowania środowiska i liczenia cząstek, które są specjalnie zaprojektowane i wykonane, aby odpowiadać wszelkim wymogom wynikającym z zapisów Aneksu 1 do GMP. Liczniki cząstek w powietrzu MET ONE, systemy FMS oraz analizatory TOC firmy Beckman Coulter Life Sciences są wykorzystywane codziennie przez badaczy, naukowców i operatorów na całym świecie, dostarczając im krytycznych, rzetelnych danych, zapewniając jakość, bezpieczeństwo i całkowitą zgodność z wymaganiami GMP.

Systemy wodne a Załącznik 1 do Rozporządzenia EU GMP
Zmieniony załącznik 1 do GMP określa wymagania dotyczące mediów, w tym wody. Dwie wyróżniające się części to sekcje 6.14 i 6.15.
Sekcja 6.14 stanowi:
Przekroczenia poziomu alarmowego powinny być dokumentowane i poddawane przeglądowi oraz obejmować badanie w celu ustalenia, czy przekroczenie poziomu alarmowego było pojedynczym (odosobnionym) zdarzeniem, czy też wyniki wskazują na niekorzystny trend lub pogorszenie stanu systemu. Każde przekroczenie limitu działania powinno zostać zbadane w celu określenia prawdopodobnych przyczyn źródłowych i potencjalnego wpływu użycia wody na jakość produktów i procesy produkcyjne.
Sekcja 6.15 stanowi:
Systemy wody do wstrzykiwań (WFI) powinny obejmować systemy ciągłego monitorowania, m.in. całkowitego węgla organicznego (TOC) i przewodności, ponieważ dają one lepsze wskazanie ogólnej wydajności systemu niż punktowe pobieranie próbek w określonych odstępach czasowych. Lokalizacje czujników powinny być wyznaczane na podstawie przeprowadzonej analizy ryzyka.
W jaki sposób analizator TOC ANATEL PAT700 może pomóc w spełnieniu wymagań
Analizator TOC ANATEL PAT700 został specjalnie zaprojektowany, aby pomóc w wykazaniu zgodności z wymaganiami farmakopei dotyczącymi TOC i przewodności dla wody oczyszczonej i systemów WFI.
|
 |
Monitoring środowiska a Załącznik 1 do Rozporządzenia EU GMP
Sekcje 4 i 9 zmienionego Załącznika 1 do Rozporządzenia EU GMP zawierają wytyczne dotyczące konkretnych potrzeb w zakresie projektowania pomieszczeń, bieżącego rutynowego monitorowania związanego z projektowaniem systemów oraz ustalania poziomów alarmowych limitów działań i przeglądania danych trendów.
Sekcja 4.28 stanowi:
W celu klasyfikacji pomieszczeń czystych minimalną liczbę miejsc pobierania próbek i ich rozmieszczenie można znaleźć w części 1 normy ISO 14644. W aseptycznym obszarze wytwarzania i w jego otoczeniu (odpowiednio obszary klasy A i B) należy rozważyć dodatkowe lokalizacje próbek i ocenić wszystkie krytyczne obszary, takie jak miejsca napełniania i zamykania pojemników. Punkty krytyczne należy określić na podstawie udokumentowanej oceny ryzyka oraz wiedzy na temat procesu i operacji, które należy wykonywać na danym obszarze.
Sekcja 9.4 stanowi:
Należy ustanowić i udokumentować program monitorowania środowiska. Celem programu monitoringu środowiska jest:
- Zapewnienie, że pomieszczenia czyste stanowią środowisko o odpowiedniej klasie czystości powietrza, zgodnie z wymaganiami projektowymi i regulacyjnymi.
- Skuteczne wykrywanie odchyleń od limitów środowiskowych, prowadzenie badań i ocen ryzyka w celu zapewnienia jakości produktu.
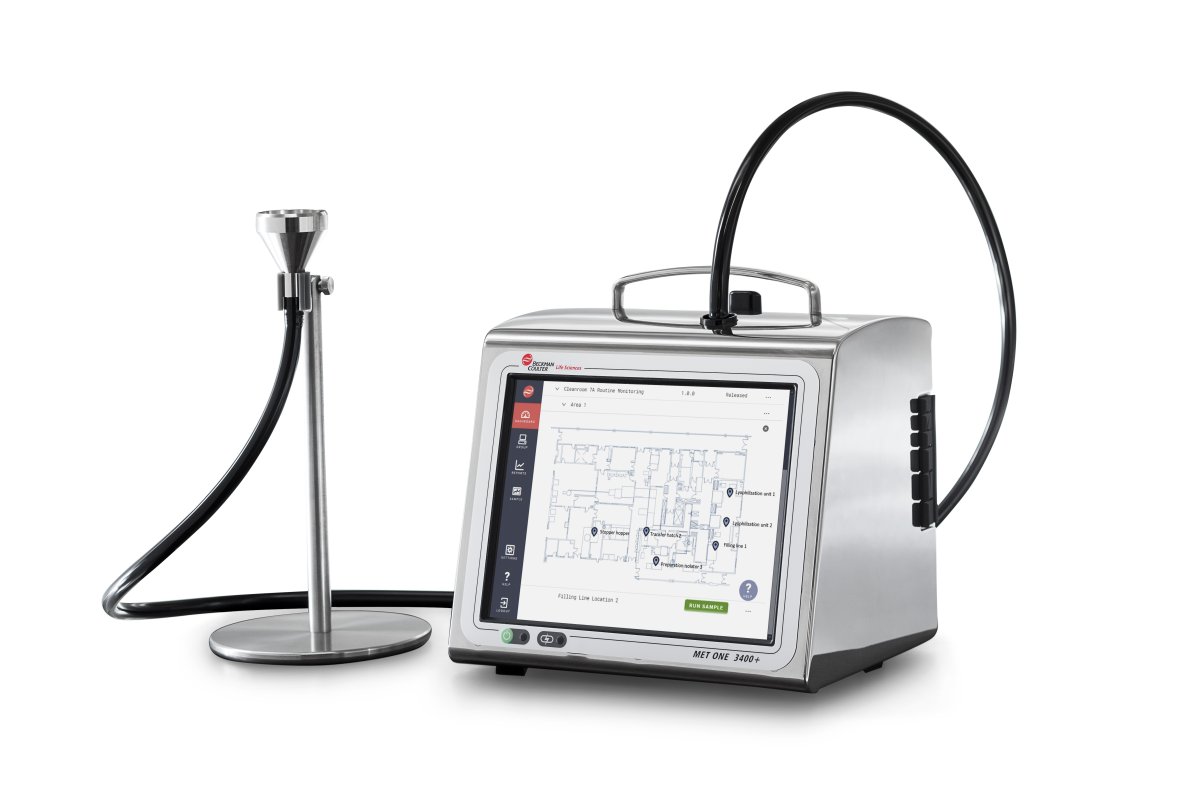
W jaki sposób liczniki cząstek w powietrzu MET ONE mogą pomóc w spełnieniu wymagań
Liczniki cząstek w powietrzu MET ONE umożliwiają monitorowanie czystości powietrza zgodnie z ISO 14644, FDA CGMP i EU GMP Annex 1.
Przenośny licznik cząstek w powietrzu MET ONE 3400+ zawiera zautomatyzowane, zintegrowane elektroniczne procedury SOP i mapy pobierania próbek.
|
• Sieć typu „plug and play” — podłączone instrumenty automatycznie tworzą sieć; • Dostosowane, elektroniczne mapy SOP — korzystając z interfejsu przeglądarki internetowej, można załadować mapę SOP do licznika, zaznaczyć lokalizacje próbek i zdefiniować wymagania SOP dla każdej z nich; • Do 26% lżejszy niż poprzednie modele — waży zaledwie 5,6 kg bez baterii. |
Systemy monitorowania obiektów (FMS)
MET ONE FMS - system ciągłego monitorowania mikroorganizmów i cząstek stałych w powietrzu
System FMS MET ONE to skalowalne, modułowe rozwiązania do ciągłego monitorowania mikrobiologii i cząstek stałych w powietrzu:
- Zwiększenie integralności danych;
- Zgodność z przepisami 21 CFR część 11;
- Mniejsze ryzyko błędu ludzkiego dzięki automatyzacji;
- Zniwelowanie odchyleń jakościowych.
|
MET ONE Zdalne liczniki cząstek stałych Zdalne próbniki mikrobiologiczne MET ONE Przenośne liczniki cząstek stałych |
 |
enVigil – System monitorowania cząstek z licznikami cząstek MET ONE 6015P i zdalnymi próbnikami mikrobiologicznymi
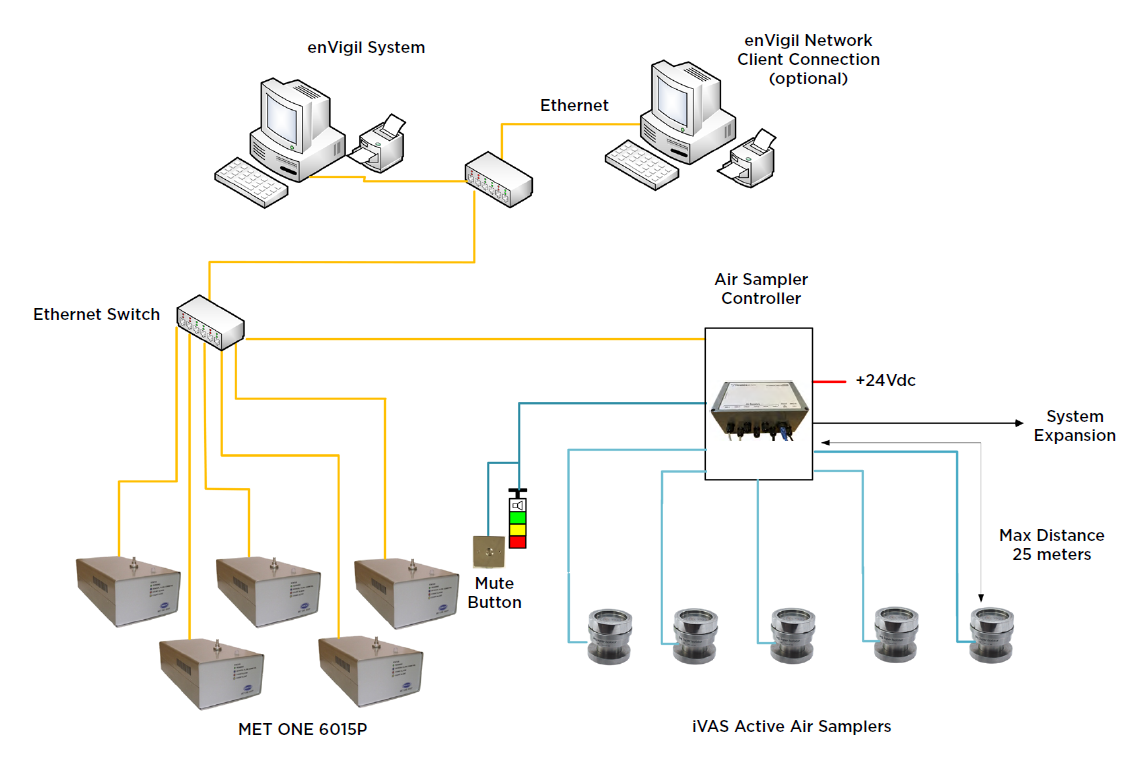
Rysunek 1. Przykład systemu enVigil PnP wyposażonego w online’owe liczniki cząstek, próbniki mikrobiologiczne oraz elementy sygnalizacyjne. Systemy można konfigurować i rozszerzać w zależności od potrzeb, włączając w to inne czujniki środowiskowe i większe systemy działające na serwerach wirtualnych.
Modułowe oprogramowanie dla małych i dużych systemów
Oprogramowanie enVigil PnP
• Gotowe oprogramowanie, łatwe w instalacji i konfiguracji,
• Idealne do mniejszych systemów, takich jak izolatory,
• Liczenie cząstek stałych i mikrobiologii w powietrzu,
• Możliwość zastosowania czujników temperatury/wilgotności względnej i różnicy ciśnień,
• Dołączone dokumenty walidacyjne,
• Do 20 liczników cząstek powietrza.
Oprogramowanie enVigil FMS
• Idealne do niestandardowych i bardzo dużych systemów,
• Liczenie cząstek stałych i mikrobiologii w powietrzu,
• Sterowniki dla wielu czujników środowiskowych,
• Konfigurowalne oprogramowanie umożliwiające dokładny opis procesu,
• Wiele opcji raportowania i trendów,
• Dostępne dokumenty walidacyjne,
• Projekt interfejsu serwera przemysłowego.



 Please wait...
Please wait...